Hidroklorik asit
HNO3 ——————-> H+ + NO3–
Nitrik asit
Asit | Sistematik Adı | Piyasa adı | Kullanım Alanı |
HCl | Hidroklorik asit | Tuz ruhu | Temizlik ürünlerinde kullanılır. |
HNO3 | Nitrik asit | Kezzap | Dinamit yapımında ve gübre üretiminde kullanılır. |
H2SO4 | Sülfürik asit | Zaç yağı | Gübre ve boya sanayinde, patlayıcı yapımında kullanılır. |
H3PO4 | Fosforik asit | Fosfat asidi | Gübre üretimi, ilaç ve gıda sanayinde kullanılır. |
Sirkede ———————————- Asetik asit
Limonda ——————————– Sitrik asit
Elmada ———————————- Malik asit
Çilekte ———————————– Folik asit
Üzümde ——————————— Tartarik asit
Süt, yoğurt —————————— Laktik asit
Turşu, ketçap, meyve suyu————Benzoik asit (Koruyucu madde)
Reçel, marmelat————————-Sorbik asit (Koruyucu madde)
Gazoz ———————————– Karbonik asit
Kolalı içecekler————————–Fosforik asit
Karınca ———————————-Formik asit
Sodyum hidroksit
KOH ——————————-> K+ + OH–
Potasyum hidroksit
Mg(OH)2 ————————->Mg+2 + 2OH–
Magnezyum hidroksit
Ca(OH)2 ————————–>Ca+2 + 2OH–
Kalsiyum hidroksit
NH3 + H2O ————————> NH4+ + OH–
Amonyak
Bazı Özel Bazlar;
Baz | Sistematik Adı | Piyasa adı | Kullanım Alanı |
NaOH | Sodyum hidroksit | Sud kostik | Sabun, kâğıt, boya, deterjan, yapay ipek yapımında kullanılır. |
KOH | Potasyum hidroksit | Potas kostik | Sabun, pil, gübre yapımında kullanılır. |
Ca(OH)2 | Kalsiyum hidroksit | Sönmüş kireç | Kireç ve çimento yapımında kullanılır. |
NH3 | Amonyak | Amonyak | Gübre üretimi, temizlik maddeleri, çamaşır suyu yapımında kullanılır. |
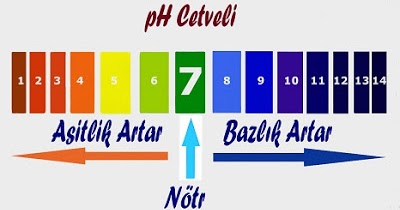
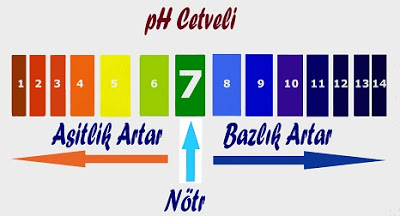
Bir çözeltinin asit yada baz olma derecesi pH derecesi ile ölçülür. pH cetveli 0-14 arasında değişmektedir. 0-7 arası asit, 7-14 arası baz özelliktedir. 7 ise nötrdür.
pH değeri 3 den küçük olanlar kuvvetli asit, pH değeri 12 den büyük olanlar kuvvetli bazdır.
Sülfürik asit —————0.3
Mide asidi ——————1
Nitrik asit—————— 1
Gazlı içecek —————-2.4
Kola ————————-2.5
Limon ———————–2.3
Sirke ————————2.9
Portakal suyu ————–3.5
Domates suyu ————–4.2
Asit yağmuru —————5.6
Kahve ———————–5.0
Çay ————————–5.5
İdrar ————————6.0
Süt ————————–6.5
Saf Su ———————-7
Tükürük ——————–7.2
Kan ————————-7.4
Göz yaşı ——————–7.4
Safra sıvısı —————–7-8
Deniz suyu —————–8.0
El sabunu ——————10.5
Amonyak ——————11.5
Kalsiyum hidroksit ——–12.4
Çamaşır suyu ————–12.5
Sodyum hidroksit ———13.5
Asitlerde kırmızı, bazlarda mavi renk alır.
Fenolftalein çözeltisi
Asitlerde renksiz, bazlarda pembe (Kırmızı) renk alır.
Metil Oranj çözeltisi
Asitlerde kırmızı, bazlarda sarı renk alır.
Mor Lahana Suyu
Asitlerde kırmızı, bazlarda mavi renk alır.
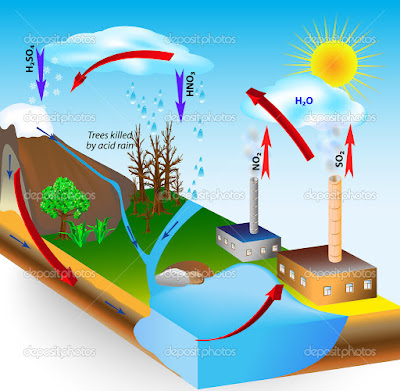
ASİT YAĞMURLARI |
SO2 + H2O ——-> H2SO4 (Sülfürik asit)
NO2 + H2O ——-> HNO3 (Nitrik asit)
CO2 + H2O ——-> H2CO3 (Karbonik asit)
Not: CO2 oluşturduğu karbonik asit diğerlerine göre zayıf bir asittir.
Asit yağmurlarında en zararlı olan SO2 ve NO2 dir.
Bu nedenle fosil yakıtlardan en zararsızı doğal gazdır. (Sadece CO2 ve H2O oluşmaktadır.)